Aspectos clave del MDR y la seguridad del paciente en la adquisición de dispositivos médicos
Desde 2021, el marco regulatorio europeo MDR (Reglamento de Dispositivos Médicos) se ha seguido de cerca en el ámbito de la tecnología médica. El objetivo principal del MDR es garantizar la seguridad del paciente mediante el establecimiento e imposición de estrictos requisitos de transparencia, documentación, trazabilidad y seguimiento relacionados con el uso de productos de tecnología médica.
¿Cómo se relaciona el MDR con la adquisición de productos de tecnología médica?
Existen varios estándares armonizados con el MDR que todo fabricante con marcado CE en sus productos debe cumplir. Estos estándares incluyen requisitos para la evaluación biológica, sistemas de gestión de calidad, gestión de riesgos, etiquetado y seguridad eléctrica.
El MDR enfatiza claramente el requisito de evidencia clínica. Esto significa que cada fabricante debe respaldar sus afirmaciones clínicas con documentos y datos clínicos comprobados. Según el MDR, atribuir características a un producto de tecnología médica sin evidencia de respaldo está estrictamente prohibido. Por ejemplo, si un producto afirma aliviar el dolor, debe haber evidencia clínica que no solo confirme que el producto está diseñado para este propósito, sino que también demuestre su rendimiento eficaz y seguro.
Según el reglamento MDR, la evidencia clínica se define como: “los datos clínicos y los resultados de evaluaciones clínicas relacionados con un producto específico. Datos que permiten una evaluación precisa de la seguridad del producto y su capacidad para lograr los beneficios clínicos previstos cuando se usa de acuerdo con las instrucciones del fabricante” (1).

Evidencia clínica en la adquisición
Para garantizar la seguridad del paciente, es crucial que las autoridades de adquisición, al evaluar productos de tecnología médica, comprendan claramente los diversos tipos de evidencia que respaldan las afirmaciones de los fabricantes sobre sus productos. Una afirmación clínica sobre un producto de tecnología médica debe estar respaldada por datos clínicos, lo que significa evidencia basada en el uso del producto durante un período específico en su entorno de usuario previsto y con sus usuarios previstos. Esto es necesario para garantizar que el producto cumpla con sus funciones declaradas y sea seguro para su uso en la práctica.
Niveles de evidencia
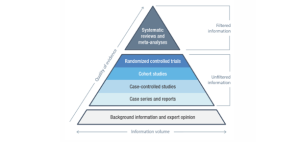
La evidencia se clasifica en función del tipo de datos clínicos y su calidad. El Anexo III del MDCG 2020-06 propone una jerarquía de datos clínicos para demostrar el cumplimiento de los requisitos generales de seguridad y rendimiento según el MDR. El rango más alto de esta jerarquía de evidencia lo ocupan estudios clínicos de alta calidad que cubren todas las variantes del producto, incluidas todas las indicaciones, grupos de pacientes, duraciones de tratamiento, etc., según lo previsto por el fabricante. Le siguen estudios clínicos de alta calidad con limitaciones a un propósito específico o a un grupo de pacientes específico. A continuación, se encuentran datos clínicos de alta calidad procedentes, por ejemplo, de estudios de registro, seguidos de resultados de estudios clínicos con limitaciones metodológicas.
La evidencia que respalda las afirmaciones clínicas también puede ser complementada por productos equivalentes donde se demuestre equivalencia y se cumplan los requisitos del MDR, pero esto no es suficiente como datos clínicos por sí solo para evaluar el cumplimiento de los requisitos generales de rendimiento y seguridad del producto. El monitoreo de seguridad, las quejas y el seguimiento proactivo posterior a la comercialización en forma de encuestas se clasifican como niveles más bajos de datos clínicos.
En la parte inferior de la jerarquía se encuentran las pruebas técnicas (como pruebas controladas en colchones que solo miden la distribución de presión) y los estudios de laboratorio realizados en condiciones controladas. Estas pruebas pueden proporcionar evidencia de apoyo y abordar medidas de resultado clínico, pero según el MDR, son inherentemente insuficientes como evidencia individual para evaluar el rendimiento clínico y garantizar que los productos sean seguros para su uso en la práctica (2, 3).
En conclusión, para garantizar el cumplimiento de las normativas y, por ende, la seguridad del paciente, es fundamental exigir evidencia clínica para los productos de tecnología médica considerados para adquisición. La capacidad de distinguir entre datos clínicos de alta calidad y datos complementarios es clave para garantizar que los productos utilizados en la atención médica cumplan con los estrictos requisitos de seguridad y calidad prescritos por el MDR.
Referencias:
1. MDR 2017/745, Artículo 2. Consultado el 2023-12-01. https://eurlex.europa.eu/legalontent/EN/TXT/HTML/?uri=CELEX:32017R0745&from=IT
2. MDCG 2020-06, Reglamento (UE) 2017/745: Evidencia clínica necesaria para dispositivos médicos previamente marcados CE bajo las Directivas 93/42/EEC o 90/385/EEC. Consultado el 2023-12-01. https://health.ec.europa.eu/system/files/2020-09/md_mdcg_2020_6_guidance_sufficient_clinical_evidence_en_0.pdf
3. Openmd. (2021) Levels of Evidence. Consultado el 2023-09-23. https://openmd.com/guide/levels-of-evidence
